En los últimos 10 años, un conjunto de datos de inmunología y biología del cáncer ha dado lugar a un mayor conocimiento de las interacciones complejas entre el cáncer y el sistema inmunitario. Esta compleja relación puede describirse mediante la hipótesis de la inmunoedición del cáncer, que abarca la dinámica del desarrollo del tumor a través del tiempo. La Figura 1 muestra un breve resumen de las 3 fases de la inmunoedición.
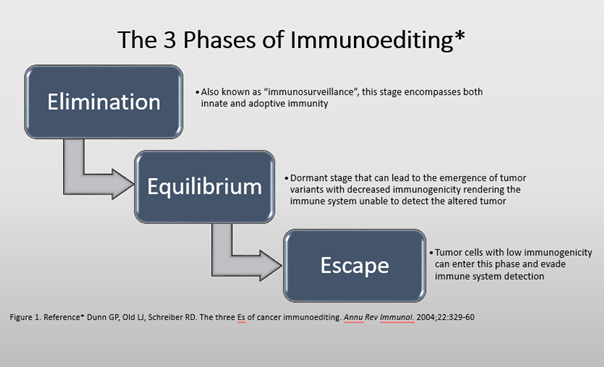
Figura 1: Fases de la inmunoedición
CTLA-4 y PD-1 son receptores de proteínas inhibidoras que se encuentran en gran parte en la superficie de los linfocitos T efectores. El ligando para PD-1, PD-L1, se expresa ampliamente en las células tumorales, ya sea endógenamente o mediante inducción por asociación con los linfocitos T (Figura 2). La diferencia entre estos receptores es el entorno en el que actúan: CTLA-4 regula la actividad de los linfocitos T en una etapa temprana, mientras que PD-1 regula la actividad de los linfocitos T efectores dentro de los tejidos y de los tumores.
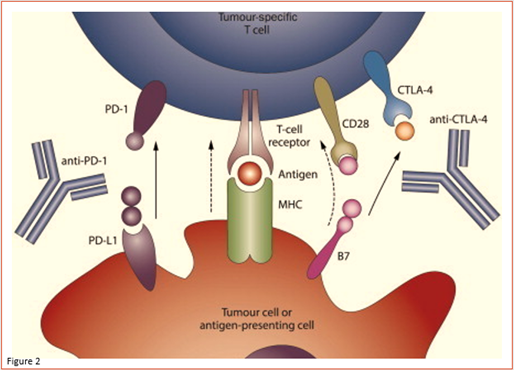
Figura 2: Proteinas de “punto de control” inmunitario en células cancerosas
Los puntos de control del sistema inmunitario suelen funcionar como «frenos» fisiológicos para prevenir la sobreactivación de los linfocitos T y así prevenir la autoinmunidad celular. Por ejemplo, la unión de PD-L1 a PD1 da lugar a la inhibición de las vías de señalización intracelular que controlan la activación de los linfocitos T. La interacción PD-1:PD-L1 da lugar a la depresión de los linfocitos T posiblemente a través de varios mecanismos (es decir, anergia, agotamiento y muerte). Por lo tanto, se ha postulado que el bloqueo de la interacción PD-1:PD-L1 con anticuerpos monoclonales dirigidos a PD-1 o PD-L1, da lugar a la inhibición de la vía de señalización PD1/PDL1, a la reactivación de los linfocitos T, generanado así respuestas antineoplásicas más fuertes. Varias proteínas, aparte de CTLA-4 y PD-1 / PD-L1 que participan en pasos cruciales del ciclo inmunitario celular, se han considerado como blancos potenciales para las inmunoterapias. Estas incluyen CD137, OX40 y CD27 (preparación y activación), el factor de crecimiento endotelial vascular (infiltración de linfocitos T en los tumores), receptores tipo Toll y CD40 (presentación de antígenos).
Referencias
- Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol. 2004;22:329-60.
- Garon EB. Current Perspectives in Immunotherapy for Non-Small Cell Lung Cancer. Semin Oncol. 2015;42(Suppl 2):S11-S18.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer.2012;12(4):252-64.
- Topalian SL, Hodi FS, Brahmer JR, et al. Safety, Activity, and Immune Correlates of Anti-PD-1 Antibody in Cancer. N Engl J Med. 2012;366(26):2443-54.
- Taube J, Anders R, Young G, et al. Colocalization of inflammatory response with B7-H1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Transl Med. 2012;4(127):127-137.
- Intlekofer AM, Thompson CB. At the bench: preclinical rationale for CTLA-4 and PD-1 blockade as cancer immunotherapy. J Leukoc Biol. 2013;94(1):25-39.
- Kim JM, Chen DS. Immune escape to PD-L1/PD-1 blockade: seven steps to success (or failure). Ann Oncol. 2016;27(8):1492-504.
